争议药品“九期一”为什么能进医保目录?官方回应
时间:2021-12-08来源:澎湃新闻客户端点击量:518
近日,一个治疗阿尔兹海默病的新药甘露特纳胶囊(商品名:九期一)通过医保谈判进入新版国家医保药品目录引发关注。12月7日,国家医保局在官方微信发布了国家医保局医药管理司相关负责同志接受采访的内容,回应了甘露特纳胶囊能够进入新版医保目录的原因。
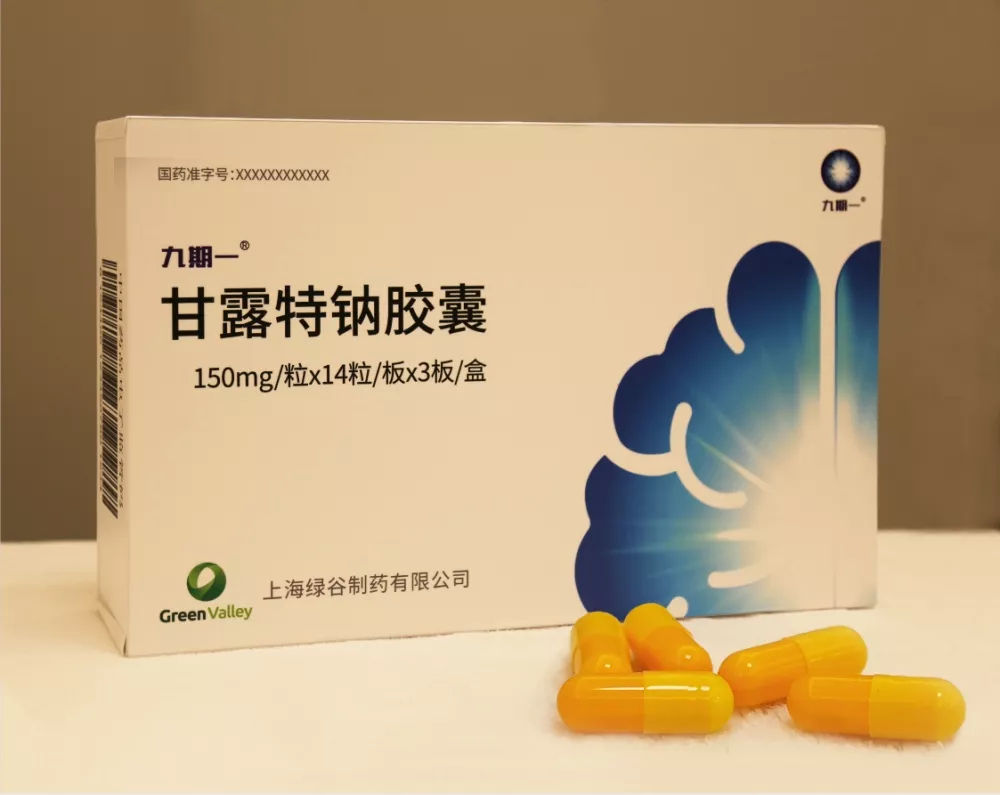
甘露特纳胶囊
国家医保局称,甘露特纳胶囊被列入“重大新药创制国家科技重大专项”支持范围。2020年、2021年均申报成功,且均顺利通过了专家评审。2020年谈判失败未被纳入目录。在今年的调整中,经过32名专家评审,得到了70.47的平均分,按规则给予该药谈判资格。通过谈判,降价66.92%纳入目录。通过谈判降价和医保报销,患者用药负担将显著降低。
国家医保局表示,由于目前纳入调整范围的药品多为新获批上市的药品,不少甚至是当年上市的药品,专家评审依靠的多是药品临床试验阶段收集的资料。在将来的工作中,我们将鼓励企业开展药品真实世界研究,在目录调整中将更多依靠真实世界研究数据。
而甘露特钠胶囊从2019年获批上市以来就引发了颇多关于其有效性争议。有学者指出甘露特钠胶囊临床试验时间太短、研究指标和采用的ADAS-cog量表能否判定疗效等质疑。
对于拟进入目录药品的有效性,在调整过程中如何把握?国家医保局表示,按照现行规则,为保证药品有效性,主要从以下几个方面着手:
一是药品必须通过药监部门审评,获批上市。《基本医疗保险用药管理暂行办法》第七条规定,纳入国家《药品目录》的药品,应当是经过国家药品监管部门批准,取得药品注册证书的化学药、生物制品、中成药(民族药)。近年来国家医保药品目录调整,主要面向近几年新获批上市的药品。
二是企业必须提交能够证明药品有效性的资料。在申报、评审、谈判等阶段,均组织相关企业按要求提交有效性等方面的数据资料及对应证据。为保证资料真实性,在申报环节对企业提交资料进行公示,接受全社会监督。请药监、卫健等部门提供药品支持资料,为评审提供支撑。
三是药品能够通过专家评审。按照调整规则,符合申报条件、申报成功的药品,需要接受药学、临床医学、药物经济学、医保管理等方面专家的多轮论证。在2021年的评审中,我们研究制定了评审指标体系,专家们从安全性、有效性、经济性、创新性(传承与创新)、公平性等方面,分别对西药和中成药进行了评审。(记者 胡丹萍)
-

关于征集第二十四届全国检察理论研究年会暨中国法学会检察学研究会年会论文的公告
第二十四届全国检察理论研究年会暨中国法学会检察学研究会年会拟于2023年5月召开,会议主题是“法律监督现代化”。
2023-02-27
-
2022年甘肃省政协理论研究会课题结项公告
经甘肃省政协理论研究会课题专家组评审,2022年立项的10项研究课题获准结项,现将评审结果公告如下
2023-01-10
-
北京阳光诺和药物研究股份有限公司第一届董事会第二十三次会议决议公告
本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性依法承担法律责任。
2022-12-20
-

中国英汉语比较研究会语言服务研究专业委员会学术论坛公告
为了促进我国语言服务行业健康发展,提升国家语言服务能力,汇聚学科交叉资源,推动我国语言服务学科建设,培养高质量的语言服务人才,并对当前语言服务领域中的热点和问题深入研讨,山西师范大学外国语学院拟于2022年11月19日承办中国英汉语比较研究会语言服务研究专业委员会第二届理事会,真诚欢迎语言服务界的广大学者和同行参会,期待与广大语言服务界同仁就新时代语言服务产业的发展热烈讨论。
2022-12-08





 京公网安备 11010602103744号
京公网安备 11010602103744号


